Nuevo mecanismo molecular contra el cáncer y enfermedades raras.
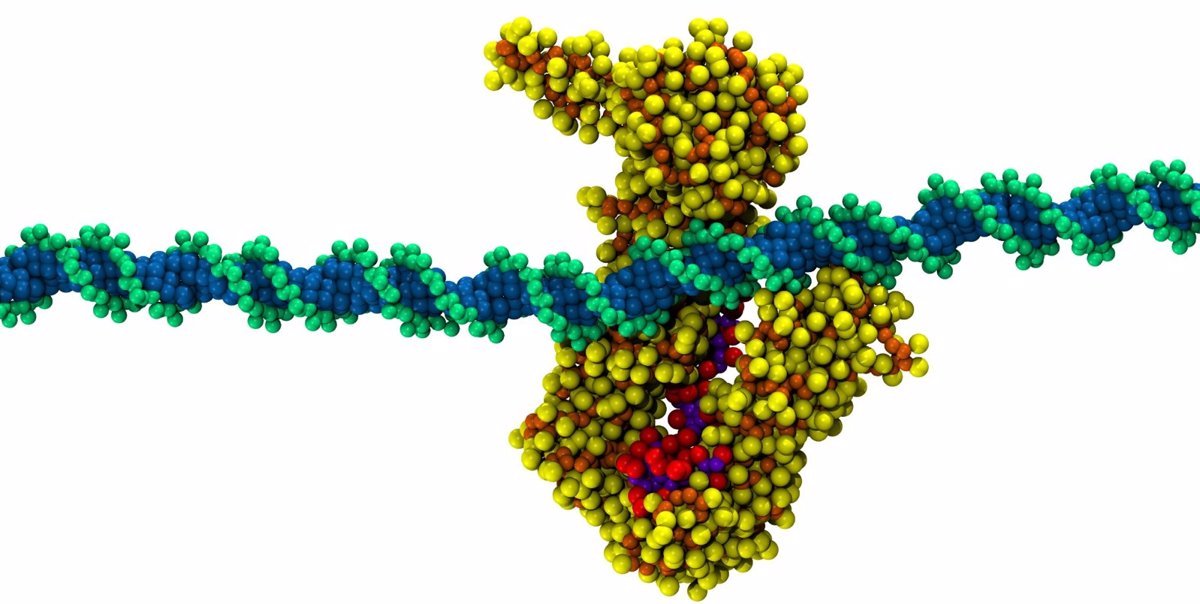
Un equipo del Consejo Superior de Investigaciones Científicas (CSIC) ha descrito un mecanismo para controlar la formación de enlaces del ADN por unas proteínas llamadas cohesinas, implicadas en procesos cancerígenos y enfermedades raras, que podría representar una nueva diana para los fármacos contra estas enfermedades.
«Los complejos de proteínas y ADN del interior de la célula se comportan como auténticas nanomáquinas», apuntan desde el CSIC. Ya se sabe mucho sobre cómo funcionan algunas de ellas, pero en otros casos apenas estamos empezando a tener una idea general de cómo se comportan, como es el caso de las cohesinas.
Están formados por un grupo de proteínas clave en los procesos de transcripción y replicación del ADN. Estas proteínas están adquiriendo especial relevancia en diversos tipos de cáncer y en el contexto de enfermedades raras como el síndrome de Cornelia de Lange, un trastorno genético que provoca retraso en el crecimiento, dismorfia facial y defectos en las extremidades, entre otros síntomas.
Lo que se sabe hasta ahora es que la función del complejo de cohesina es generar, de forma controlada, grandes bucles de ADN. Pero se sabe poco sobre sus mecanismos de control.
Utilizando herramientas de simulación computacional, el grupo de Modelado Molecular del Centro de Biología Molecular Severo Ochoa (CSIC-UAM), dependiente del Ministerio de Ciencia, Innovación y Universidades (MICIU), propuso por primera vez un mecanismo de trinquete que involucra a las proteínas STAG2 y RAD21. Este mecanismo permite el alargamiento unidireccional de los bucles de ADN, al tiempo que bloquea el retroceso y, por tanto, el acortamiento de estos bucles.
En los últimos años, destacados grupos de investigación de todo el mundo han propuesto varios mecanismos para explicar cómo se forman los enlaces del ADN en la estructura del complejo de cohesina.
«Algunos han propuesto mecanismos similares a los de las orugas, en los que las proteínas se mueven a lo largo del ADN como una oruga en una rama. Otros proponen mecanismos de bombeo, similares a los de una oruga, pero sin el movimiento de arrastre del complejo.
«Independientemente del tipo de avance, todos estos modelos necesitarían un sistema para evitar que el complejo proteico retroceda una vez que ha empujado el ADN hacia adelante», explican los investigadores del CBM David Ros-Pardo, Íñigo Marcos-Alcalde y Paulino Gómez-Doors. Sin embargo, hasta la fecha, no se ha propuesto ningún componente del sistema con una función de mecanismo de bloqueo capaz de proporcionar direccionalidad al proceso.
Esta es la principal novedad del estudio publicado recientemente en el «International Journal of Biological Macromolecules», que propone un papel para dos de las proteínas del complejo, STAG2 y RAD21, que actuarían como un sistema de seguridad capaz de permitir avances, pero no regresión.
«Este sistema funcionaría como un mecanismo de trinquete, similar a la pestaña de una brida de plástico, permitiendo que la cinta de la cremallera avance, pero sólo en una dirección», añaden los investigadores. El conjunto STAG2/RAD21 permitiría el deslizamiento unidireccional del ADN, facilitando así la extensión de los bucles y evitando su colapso.
Para llevar a cabo este estudio se utilizaron técnicas computacionales de modelización dinámica molecular, tanto a escala atómica como a escalas ligeramente mayores, conocidas como simulaciones de «grano grueso». Este tipo de enfoques permiten tiempos de simulación de unos pocos microsegundos en sistemas complejos, es decir, sistemas que contienen múltiples proteínas que se mueven a lo largo de cadenas de ADN de más de cien pares de bases.
Todo ello se ha conseguido gracias a sistemas informáticos de altas prestaciones, como los que alberga el Centro de Informática Científica de la Universidad Autónoma de Madrid (UAM), integrados en la red de supercomputación española.
Este estudio permite, por primera vez, comprender la regulación de la formación de enlaces del ADN, un mecanismo clave en procesos celulares como la expresión génica o la división celular. «Es importante destacar que proporciona información mecanicista para bloquear el deslizamiento del ADN y convierte a las proteínas STAG2 y RAD21 en nuevos objetivos potenciales en el desarrollo de fármacos», explican los científicos de CBM.
Estos medicamentos pueden detener o regular la división celular como futuros tratamientos contra el cáncer o como posibles tratamientos para el síndrome de Cornelia de Lange y otras enfermedades raras relacionadas.
FUENTE